Разделы сайта
- Главная
- Электроника: интересно и познавательно
- Организация производства радиоэлектронной техники
- Телефонные переговоры по технологии IP-телефонии
- Информационно-компьютерная система службы видеонаблюдения
- Физические основы электроники
- Автоматические системы управления
- Цифровые устройства и приемники
Строение твердых тел
Все вещества - газообразные, жидкие и твердые - состоят из атомов и молекул. Способность атомов вступать в соединение с атомами других элементов и образовывать молекулы, обусловлены внешними валентными электронами.
Существующие виды связей:
а) ковалентная связь
(рисунок 1.1) характеризуется образованием устойчивых электронных пар электронов, ранее принадлежавших отдельным атомам. Эти пары становятся общими для атомов, входящих в состав молекулы. Электроны при движении по молекулярной орбите чаще всего находятся между ядрами, где создается как бы избыток отрицательного заряда, что способствует сближению атомов.
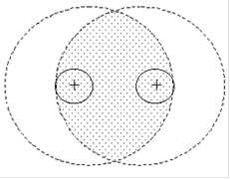
Рисунок 1.1 - Молекулы с ковалентной связью
Если двухатомная молекула состоит из атомов одного элемента (H2, N2, Cl2), то электронная пара в равной степени принадлежит обоим атомам, такую молекулу называют неполярной или нейтральной, у них центры положительных и отрицательных зарядов совпадают.
Если двухатомная молекула состоит из атомов различных элементов, то электронная пара может быть смещена к одному из атомов. Такую ковалентную связь называют полярной, а молекулу с полярной связью, у которой центры зарядов не совпадают, - полярными или дипольными. Дипольная молекула характеризуется величиной электрического дипольного момента, измеряемого в Кл·м:
![]() ,
,
где q - значение заряда, Кл;
l - расстояние между центрами зарядов.
Материалы с ковалентными связями характеризуются высокой твердостью, тугоплавкостью (Кремний).
б) ионная связь
- вызывается силами электрического притяжения между положительными и отрицательными ионами. К ним относятся ряд металлов и типичные металлы. Например: хлористый цезий ClCs и титанита барий BaTiO3, оксиды Cu2O, ZnO, Fe2O3, NiO. Молекулы таких веществ - полярные, ионная связь менее прочная, чем ковалентная.
в) металлическая связь
, в основном в металлах. Атом, отдавший внешний электрон, превращается в положительный ион, или вновь присоединяется, превращаясь в нейтральный атом. Т.е. металл можно рассматривать как систему, построенную из положительных ионов, находящихся в среде свободных электронов.
2. Кристаллическое строение веществ:
а) кристаллические
- если атомы или молекулы характеризуются геометрически упорядоченным расположением;
б) аморфные
(бесструктурные) - характеризуются хаотическим расположением;
в) аморфно - кристаллические
, т.е. могут находиться как в кристаллическом, так и в аморфном состоянии (SiO2).
3. Кристаллические вещества
- это большинство твердых веществ обладающих кристаллическим строением. Форма внутреннего строения - это геометрически правильное расположение атомов или молекул. Кристаллические решетки классифицируют по виду частиц и по форме элементарных ячеек. Возможны 14 видов пространственных решеток: триклинная, моноклинная, таллическая, тетрагональная, ромбоэдрическая, гексагональная, кубическая и т.д.
Триклинная
- обладает наименьшей пространственной асимметрией, так как все ребра ячейки различны и не составляют между собой прямого угла.
Кубическая
- наибольшая пространственная симметрия, так как ребра одинаковы, между собой составляют прямой угол.
Остальные - занимают промежуточные положения.
Кристаллические решетки обладают размерами, которые характеризуют ее параметр - это расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку.
Параметр кубической решетки обозначают буквой, а
≈0,28-0,6 Нм.
Параметр гексагональной решетки - обозначается двумя индексами: а- сторона шестигранника, с
- высота призмы.
В зависимости от вида частиц, образующих кристаллическую решетку, различают: атомные, ионные, металлические и молекулярные решетки.
Атомные
- в узлах нейтральные атомы связанные ковалентной связью.
Ионные
- в них чередуются положительные и отрицательные ионы (ионная связь).
Металлические
- в узлах положительные ионы, в промежутках - свободные электроны.
Молекулярные
- в узлах молекулы, а связь - ковалентная и ионная.
4. Дефекты кристалла
Кристаллическая решетка.
Полупроводники, как правило, - твердые тела с регулярной кристаллической структурой - монокристаллы. Их кристаллическая решетка состоит из множества повторяющихся и примыкающих друг к другу элементарных ячеек
той или иной формы и размера. В случае простейшей кубической решетки (Ge, NaCl и др.) ребро элементарной ячейки - куба - есть постоянная решетки а(0,4-0,6 нм). Кубическая решетка типа алмаза (Si, Ge) состоит из тетраэдров (рисунок 1.2); расстояние между смежными атомами около 0,25 нм.
Интересное из раздела
Повышение технологичности печатного узла усилителя на ОУ
Целью данного курсового проекта является повышение технологичности
печатного узла усилителя на ОУ за счет применения прогрессивных методов монтажа
SMD-к ...
Автоматическая система управления
В настоящее время широко используются микропроцессорные устройства и системы. Их назначение и область применения очень велика. Так, различного рода микропроцессорные сист ...
Расчет линейной электрической цепи при гармоническом воздействии
Цель
курсовой работы состоит в практическом освоении методов расчета простых и
сложных электрических цепей при воздействии на них гармонических колебани ...